|
Professeur A. TAZI, |
 |
Chez l’adulte :
L’histiocytose pulmonaire primitive est une maladie rare dont on ne connaît pas la fréquence pour plusieurs raisons :
Pour l’ensemble des patients :
On dispose de très peu de données sur la fréquence mais c’est une maladie dont on sait qu’elle survient quasi exclusivement, pour entre 90 et 100 % des cas dans les séries de patients étudiés, chez des fumeurs.
Cette forme d’atteinte primitive est très liée au tabac.
A l’examen des séries on constate que c’est une maladie du sujet jeune. La maladie survient avec un pic de fréquence entre 20 et 40 ans. La forme primitive de la maladie peut survenir plus tard chez la femme, jusqu’à 50 ans.
Il y a quelque temps, on pensait de ce côté de l’Atlantique que c’était une maladie de l’homme principalement et de l’autre, aux USA, on constatait que les femmes étaient aussi sujettes que les hommes à faire une histiocytose pulmonaire primitive, voire même avec une certaine prédominance.
L’explication avancée est que les hommes faisaient le service militaire et que les médecins militaires voyaient une proportion importante d’ hommes jeunes et… qui fumaient.
Aux USA, les femmes ont fumé plus tôt qu’en Europe et on a donc commencé à voir des cas chez les femmes américaines avant les femmes européennes.
On n’a pas toutes les réponses à cette question.
Beaucoup de gens fument et une toute petite minorité déclare une histiocytose. Alors pourquoi ?
Il y a manifestement un terrain favorisant mais le tabac joue probablement un rôle déclenchant.
La maladie se déclare chez des personnes qui peuvent ne pas fumer depuis longtemps mais qui fument beaucoup.
Un certain nombre de travaux ont été menés.
On constate que le tabac entraîne des anomalies au niveau des bronches et des bronchioles.
Or, dans la maladie, les lésions présentes sont la destruction des bronchioles.
On observe des nodules, c’est-à-dire des masses constituées par des cellules langerhansiennes (= cellules qui participent à la défense immunitaire) qui au début de la maladie se trouvent au niveau des voies aériennes distales, donc des bronchioles. Les nodules ont la particularité de détruire les bronchioles, de faire des trous dans les poumons.
A la radio, la maladie apparaît donc sous la forme de petites boules (les nodules) et de trous dans les poumons.
Il est évident que le poumon avec beaucoup de trous ne fonctionne plus.
Une manifestation un peu particulière dans la maladie attire l’attention : le pneumothorax.
Un pneumothorax peut survenir, en fait dans la majorité des cas, chez une personne qui ne présente pas d’histiocytose, généralement des sujets jeunes fumeurs et parfois dans d’autres maladies comme l’emphysème par exemple.
Souvent cependant le pneumothorax arrive chez des fumeurs.
Il consiste dans l’entrée d'air dans la plèvre (= la membrane qui entoure le poumon). La plèvre se décolle et le poumon "se ratatine".
Cela fait mal. Cela essouffle.
La plèvre peut revenir en place seule ou bien, avec des techniques chirurgicales assez simples, la plèvre est recollée.
Le pneumothorax intervient dans 10 à 20 % des cas chez les personnes atteintes d’histiocytose pulmonaire.
Indépendamment du problème immédiat de la douleur qu’il cause et de l’essoufflement qui en résulte, si le pneumothorax se produit à répétition, cela pose des problèmes particuliers.
Donc quand une personne de 25 ou 30 ans, qui est fumeur, fait un pneumothorax, s’il y a une maladie pulmonaire sous-jacente on aura l’esprit attiré par la possibilité d’une histiocytose.
Le scanner
Un grand progrès a été apporté dans les méthodes diagnostiques grâce au scanner. On ne peut pas concevoir aujourd’hui de faire un bilan d’histiocytose pulmonaire sans procéder à un scanner. Un scanner en haute résolution permet de bien voir le poumon.
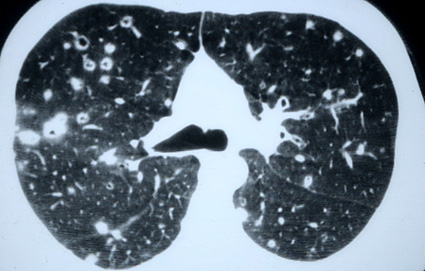
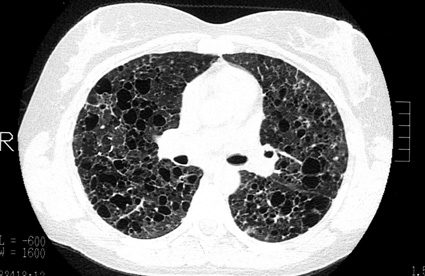
Pour une équipe bien entraînée, en écartant un certain nombre de signes (les patients n’ont pas d’infection, pas de VIH positif, pas de fièvre, se portent pas trop mal), sur le scanner seul, on peut alors porter le diagnostic avec une très forte probabilité.
La fibroscopie
Pour explorer le poumon, on dispose de l’examen appelé fibroscopie. On descend un tuyau muni d’une fibre optique dans les bronches, ce qui fait un peu tousser mais n’est pas très douloureux. Dans la majorité des cas, cet examen est pratiqué sous anesthésie locale. On va ainsi voir ce qu’il y a dans les bronches.
En général, on ne voit qu’une inflammation parce que les gens fument.
On peut aussi procéder à un prélèvement lors de la fibroscopie, mais ce prélèvement de la muqueuse des bronches n’apporte rien pour le diagnostic de l’histiocytose lui-même. Il permet d’éliminer les autres causes dans la recherche du diagnostic.
Le lavage alvéolaire
Pendant les années 80, le lavage alvéolaire constituait un espoir pour le diagnostic. Celui-ci représente grossièrement pour le pneumologue, la numération sanguine du poumon.
On injecte du liquide qui va séjourner très peu de temps dans les alvéoles, les parties respiratoires les plus distales du poumon, on recueille ensuite ce liquide et on l’analyse.
On croyait alors que par ce lavage on allait pouvoir recueillir les cellules de langerhans et dire que si elles se trouvent en grand nombre, il s’agit d’une histiocytose. C’était un espoir pour le test diagnostique qui évitait d’aller plus loin et de pratiquer une opération qui consistait à prélever un fragment de poumon pour l’analyser et faire le diagnostic.
Contrairement à la peau, aux ganglions, au foie que l’on peut assez facilement biopsier (à travers la paroi donc sans grosse opération), le poumon n’est pas un organe facile d’accès, les bronchioles distales qui sont atteintes dans la maladie se trouvant tout au fond.
Actuellement, avec le recul, on est beaucoup moins sûr du lavage alvéolaire car on sait que l’accumulation de cellules de Langerhans est essentiellement le reflet du tabac. On peut en effet trouver un pourcentage non négligeable de cellules de Langerhans dans les poumons de personnes qui fument mais qui n’ont pas d’histiocytose. En reprenant pour une étude un nombre important de sujets qui ont eu un lavage alvéolaire pour une histiocytose ou autre, on s’est aperçu que dans le groupe de personnes adultes atteintes d’histiocytose, la majorité n’avait pas des taux élevés de cellules de Langerhans.
Cela s’explique assez bien par le fait que l’histiocytose touche les bronches distales, c’est-à-dire les "tuyaux" et pas l’alvéole qui, elle, est la partie la plus profonde du poumon.
La biopsie transbronchique
Parfois, on peut faire une intervention un peu plus poussée et pratiquer une biopsie transbronchique, c’est-à-dire aller le plus loin possible, traverser les bronches et prélever un petit fragment de poumon.
Cette intervention n’est pas anodine car si on fait une biopsie dans un trou - présent dans l’histiocytose-, il y a risque de pneumothorax.
Peu d’équipe en France font des biopsies transbronchiques pour la recherche du diagnostic de l’histiocytose. Cela est plus fréquent aux USA.
L’évaluation du souffle
Dans tous les cas, il faut procéder à la mesure de la fonction respiratoire qui permet de mesurer le retentissement objectif de la maladie au niveau du poumon. Cela permet parfois aussi d’orienter le diagnostic vers l’histiocytose.
La biopsie pulmonaire chirurgicale
La biopsie pulmonaire chirurgicale est le seul moyen de faire un diagnostic avec certitude.
Elle se pratique sous anesthésie générale.
Maintenant, grâce à la thoratoscopie la technique opératoire a été allégée. On ne fait plus de grandes ouvertures au patient, mais trois petits trous par lesquels on introduit une fibre optique et des instruments qui permettent de procéder au prélèvement.
Cette biopsie doit être faite à bon escient et correctement :
Une biopsie pulmonaire sera donc pratiquée s’il y a un doute sur la possibilité d’une autre maladie. Et s’il ne s’agit pas d’une histiocytose, un traitement pourra alors être proposé.
S’il s’agit finalement d’une histiocytose, il faut pouvoir être amené à discuter d’un certain nombre de propositions thérapeutiques.
Il est à noter que pour d’autres maladies, on peut parler de traitement ; pour l’histiocytose on parle de “propositions thérapeutiques”.
1) Pourquoi alors que beaucoup de gens fument, je fais, moi, une histiocytose ?
2) Que vais-je devenir ? quelle est l’évolution ?
3) Que me proposez-vous comme traitement ?
Il n’est pas facile au médecin de répondre à ces questions.
Pourquoi ?
Hypothèse : Le tabac entraînant des lésions des bronchioles, si la personne présente un terrain favorisant où les cellules de Langerhans sont au départ peut-être un peu "anormales" ou facilement excitables, et ceci est une hypothèse sur laquelle nous travaillons, on peut imaginer que le tabac est un facteur déclenchant de stimulation qui fait qu’ensuite les choses vont s’organiser vers la maladie : présence de granulomes, c’est-à-dire de masses compactes de cellules de Langerhans dans les bronchioles et destruction de celles-ci.
Evolution possible de la maladie ?
Pour répondre le plus précisément possible à cette question, on ne peut que souhaiter que des avancées soient faites au niveau de la recherche clinique, de la constitution de réseaux de médecins et de registre de patients.
Les données pour avancer un certain nombre de réponses sont rétrospectives, elles analysent le passé.
Pour un seul individu la réponse n’est pas très facile à donner.
Ce que l’on sait statistiquement :
Sur la radio (pas sur le scanner), on voit en effet très bien les taches blanches mais on ne voit pas facilement les trous. Si les taches blanches disparaissent à la radio, on peut penser qu’il y a amélioration alors qu’elles seront en fait remplacées par des trous, invisibles à la radio.
Le suivi du patient sera donc effectué par l’étude du souffle.
Les patients stables peuvent le rester parfois très longtemps, sans toutefois pouvoir exclure dans un certain nombre de cas, une petite poussée un moment plus tard.
Facteurs pronostiques
Un certain nombre de facteur pronostiques ont été individualisés dans une étude rétrospective :
Autres possibilités d’évolution
Un des leitmotiv dans la conversation avec le patient sera à propos de l’arrêt du tabac.
Pourquoi arrêter de fumer ?
- Parce qu’un certain nombre de malades vont avoir une régression spontanée de leur maladie à l’arrêt de tabac, surtout si elle est récente.
- Il faut savoir que si on continue de fumer, on surajoute les méfaits du tabac sur un poumon déjà malade. Les méfaits du tabac, c’est-à-dire :
Ce chapitre est le plus embarrassant pour le médecin. Il n’a pas grand-chose de spécifique à proposer.
L’arrêt du tabac ne peut pas être réellement considéré comme un traitement, bien que simple et qui peut être gagnant.
La cortisone
La cortisone a été proposée car elle diminue l’inflammation donc les conséquences pour le poumon. Cela marche sur les signes généraux de la maladie comme la fièvre, les sueurs, la fatigue. Il n’y a pas de preuve formelle qui montre que cela marche sur la fonction respiratoire, donc sur le souffle.
Comme il s’agit d’une maladie rare, on ne dispose pas d’essais cliniques par lesquels on peut comparer un groupe de patients auxquels on donne de la cortisone à un autre à qui on ne donne rien.
Une des choses les plus importantes pour les années à venir sera l’établissement d’un protocole d’essai thérapeutique, en essayant d’individualiser les formes avec les conséquences respiratoires et d’étudier les bénéfices du traitement d’essai.
Il ne paraît cependant pas raisonnable actuellement de traiter des personnes qui ont une anomalie au scanner mais qui ne se plaignent de rien.
Le pneumothorax et son traitement
Il faut être très vigilant quand on intervient sur le pneumothorax d’un patient atteint d’histiocytose.
Il ne faut pas enlever la plèvre, car on ne pourra ensuite plus décoller s’interdisant la possibilité de l’indication thérapeutique pour les formes très évoluées : la greffe pulmonaire.
Les chirurgiens commencent à connaître cela. Il ne faut pas enlever la plèvre à un patient présentant une histiocytose avec pneumothorax.
La greffe pulmonaire
Le succès des greffes pulmonaires pour l’histiocytose est similaire à celui des autres indications de greffe pulmonaire pour d’autres maladies.
La greffe pulmonaire reste une intervention lourde qui n’a rien de comparable avec les greffes des autres organes comme le rein par exemple.
Les indications de greffe pulmonaire pour l’histiocytose sont assez limitées.
Des personnes jeunes qui font des pneumothorax à répétition et qui évoluent vers une insuffisance respiratoire seront greffées. De même que les personnes présentant une forte pression artérielle pulmonaire.
Pour un large panorama où l’on sait un certain nombre de choses, beaucoup de déception s’affiche sur la partie traitement de l’histiocytose langerhansienne pulmonaire.
Le message à faire passer pour l’avenir pour que des avancées soient réalisées :